Vzorec amoniaku. Hydroxid amónny je vodný roztok amoniaku
Amoniak - nitrid vodíka - jedna z najdôležitejších zlúčenín dusíka a vodíka. Je to plyn bez farby, ale so špinavým zápachom. Chemické zloženie odráža vzorec amoniaku - NH3, Zvyšovanie tlaku alebo zníženie teplotyvedie k jej premenu na bezfarebnú kvapalinu. Plynný amoniak a jeho roztoky sa široko používajú v priemysle a poľnohospodárstve. V medicíne sa používa 10% hydroxid amónny - amoniak.
Štruktúra molekuly. Elektronický vzorec amoniaku
Molekula nitridu vodíka sa podobápyramída, na ktorej báze je dusík, spojená s troma atómami vodíka. Väzby N-H sú silne polarizované. Dusík silnejšie priťahuje väzbový elektrónový pár. Preto sa negatívny náboj akumuluje na atómoch N, pozitívny náboj sa koncentruje na vodík. Model tejto molekuly, elektronický a štruktúrny vzorec amoniaku, poskytuje myšlienku tohto procesu.

Nitrid vodíka sa veľmi dobre rozpúšťa vo vode(700: 1 pri 20 ° C). Prítomnosť prakticky voľných protónov vedie k vzniku mnohých vodíkových "mostov", ktoré spájajú molekuly dohromady. Vlastnosti štruktúry a chemického spojenia tiež vedú k tomu, že amoniak sa ľahko skvapalňuje zvyšovaním tlaku alebo znížením teploty (-33 ° C).

Pôvod názvu
Termín "amoniak" sa zaviedol do vedeckého použitia v roku 20081801 na návrh ruského chemikária Ja Zakharova, ale podstata ľudstva je známa už dávno. Plyn so štipľavým zápachom sa uvoľňuje pri rozkladaní produktov životnej aktivity, mnohých organických zlúčenín, napríklad proteínov a močoviny, počas rozkladu amónnych solí. Historici chémie veria, že látka bola pomenovaná podľa starobylého egyptského boha Amuna. V Severnej Afrike je oáza Siwa (Amónia). Obklopené libyjskou púšťou sú zrúcaniny starobylého mesta a chrámu, vedľa ktorých sú usadeniny chloridu amónneho. Táto látka sa v Európe nazývala "Amónna soľ". Existuje tradícia, že obyvatelia oázy Siwa čuchali soľ v chráme.
Príprava nitridu vodíka
Anglický fyzik a chemik R. Boyle pri pokusoch spálil hnoj a pozoroval tvorbu bieleho dymu nad tyčinkou navlhčenou kyselinou chlorovodíkovou a zaviedla do prúdu výsledného plynu. V roku 1774 ďalší britský chemik, D. Priestley, zahrieval chlorid amónny s hydratovaným vápnom a oddelil plynnú látku. Priestley nazval zlúčeninu "alkalický vzduch", pretože jeho riešenie preukázalo vlastnosti slabej základne. Bol vysvetlený Boyleov experiment, pri ktorom sa amoniak nechal reagovať s kyselinou chlorovodíkovou. Pevný chlorid amónny bielej farby nastáva, keď molekuly reagujúcich látok prichádzajú do styku priamo vo vzduchu.

Chemický vzorec amoniaku bol stanovený v1875 K. Berthollet Francúzom, ktorý vykonal experiment na rozkladu látok na jednotlivé zložky podľa elektrického výboja. Až doteraz pokusy Priestley, Boyle Berthollet a reprodukovať v laboratóriu na produkciu vodíka nitrid a chlorid amónny. Priemyselná metóda bola vyvinutá v roku 1901 A. Le Chatelierom, ktorý dostal patent na spôsob syntézy látky z dusíka a vodíka.

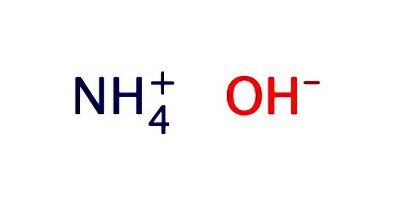
Roztok amoniaku. Vzorec a vlastnosti
Vodný roztok amoniaku sa zvyčajne zaznamenáva ako hydroxid-NH4OH. Vykazuje vlastnosti slabých zásad:
- disociuje na ióny NH3 + H2O = NH4OH = NH4+ + OH-;
- sfarbenie roztoku fenolftaleínu v karmínovej farbe;
- interaguje s kyselinami na vytvorenie soli a vody;
- precipituje Cu (OH)2 ako jasne modrá látka, keď sa zmieša s rozpustnými soľami medi.
Rovnováha pri reakcii amoniaku svoda je posunutá smerom k surovinám. Predhriaty nitrid vodíka dobre spaľuje v kyslíku. Oxidácia dusíka sa vyskytuje na diatomických molekulách jednoduchej látky N2. Redukčné vlastnosti amoniaku sa prejavujú aj pri reakcii s oxidom medi.

Hodnota amoniaku a jeho roztokov
Nitrid vodíka sa používa pri výrobe solíkyselina amónna a kyselina dusičná - jeden z najdôležitejších produktov chemického priemyslu. Amoniak slúži ako surovina na výrobu sódy (podľa metódy dusičnanov). Obsah nitridu vodíka v priemyselnom koncentrovanom roztoku dosahuje 25%. V poľnohospodárstve sa používa vodný roztok amoniaku. Vzorec tekutých hnojív - NH4OH. Látka sa priamo používa ako vrchný obväz. Ďalšími spôsobmi obohacovania dusíka v pôde je použitie amónnych solí: dusičnanov, chloridov, fosfátov. V priemyselných podmienkach a poľnohospodárskych priestoroch sa neodporúča skladovať minerálne hnojivá obsahujúce amóniové soli spolu s alkáliami. Ak dôjde k narušeniu integrity obalu, môžu látky reagovať navzájom, aby vytvorili amoniak a uvoľnili ho do ovzdušia priestoru. Táto toxická zlúčenina nepriaznivo ovplyvňuje dýchaciu sústavu, centrálnu nervovú sústavu človeka. Zmes amoniaku a vzduchu je výbušná.
</ p>







